在温和条件下制备和表征胶体二氧化硅颗粒
Frances Neville, Azrinawati Mohd. Zin, Graeme J. Jameson, and Erica J. Wanless <br> 环境与生命科学学院 和 工程学院, 纽卡斯尔大学, 卡拉汉, 新南威尔士州 2308, 澳大利亚
(S) 支持信息
摘要
本文描述了一个在中性pH和环境温度条件下制备和表征二氧化硅颗粒的微型实验室实验。学生首先采用实验制造方法,通过烷氧基硅烷和聚乙烯亚胺的缩合反应来制造球形亚微米二氧化硅颗粒,其中聚乙烯亚胺在磷酸盐缓冲液存在下催化该反应。随后是采用尺寸和成像方法来表征这些颗粒,这使学生能够描述颗粒生长,并提高他们在解释使用不同方法获得的结果方面的技能。这种二氧化硅颗粒合成方法相对于Stöber法的优势在于,它不需要极端的pH或温度条件。此外,本实验中使用的化学品危害性小于通常用于制造二氧化硅颗粒的化学品。
关键词: 高年级本科生, 实验教学, 物理化学, 动手学习/操作, 胶体, 材料科学, 微型实验, 纳米技术, 沉淀/溶解度
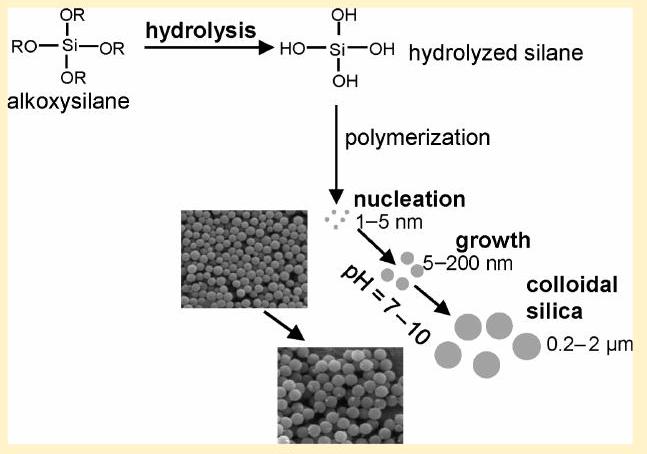
胶体二氧化硅通常是通过“溶胶-凝胶”法合成的,该方法最初由 Stöber 和 Fink 进行,涉及苛刻的化学条件,例如 5 M 甲醇和 14 M 氨。 四烷氧基硅烷溶液的初始酸化产生 ,它聚合成极小的二氧化硅颗粒或核(方案1),其尺寸通常在
方案1. 胶体二氧化硅合成的一般方法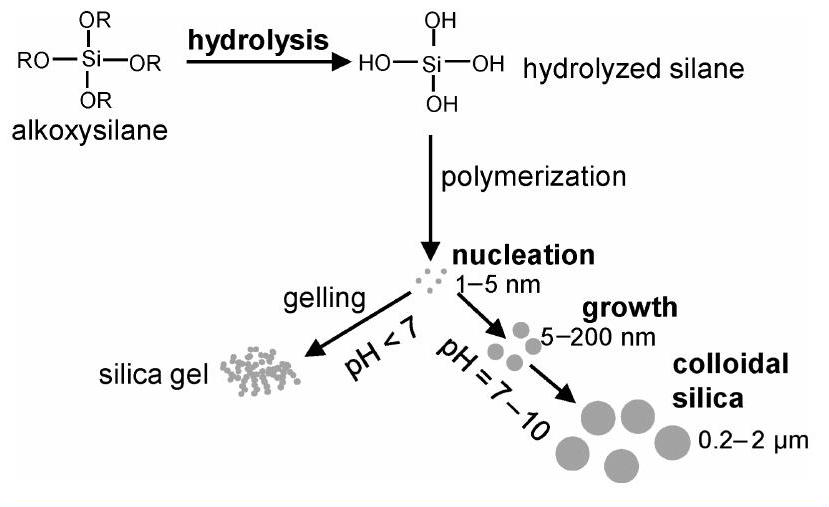
的范围内。这些核是否生长取决于聚合的条件。如果pH降至7以下或加入盐,核单元倾向于融合成链状。这些产物通常被称为“硅胶”。如果pH保持在中性偏碱性,核会保持分离,并逐渐生长,产生尺寸为几十到几千纳米的颗粒。Buckley 和 Greenblatt 提供了胶体二氧化硅形成所涉及反应的化学描述。 尺寸由反应时间和所用不同试剂的比例控制。本实验的目的是用一种比先前展示的更快速、条件更温和的方法来生产胶体二氧化硅颗粒。
本实验涉及胶体二氧化硅颗粒的制备和表征,并涉及颗粒尺寸控制的基础研究。它在微观尺度上进行,以减少浪费并增强安全控制,因为使用的体积小,溢出被最小化。该实验基于一个先前的研究项目,该项目已被改编为实验室实验。过去两年,该实验已由本科三年级的理科或理科教学专业的学生进行,作为聚合物和胶体化学课程的一部分。 图示的胶体二氧化硅合成方法(方案1)通常涉及烷氧基硅烷****原硅酸四乙酯 (TEOS) 或原硅酸四甲酯 (TMOS) 的水解和缩合,这些物质是易燃、有害且有毒的(TMOS),同时使用氨作为碱性催化剂在乙醇水溶液中进行。这里使用了危害性较小的三甲氧基甲基硅烷 (TMOMS),并在室温下进行了温和的酸水解(表S1,支持信息)。 聚合物****聚乙烯亚胺被用作碱性催化剂,因为它比氨的危害性小,并且其结构与自然界中发现的多胺相似,在自然界中也会发生硅化,例如在海洋藻类中。
[^0]缩合反应的引发取决于试剂的摩尔比,并且在加入水解的 TMOMS 几分钟后可以观察到。这种转变之后,形成了一个浑浊的白色分散体。形成的胶体二氧化硅颗粒的尺寸和形态取决于反应时间。尺寸范围可以从几十纳米控制到微米级的颗粒,并且由于尺寸小,所得胶体二氧化硅的比表面积非常高。
- 实验
化学品
三甲氧基甲基硅烷 (TMOMS)、盐酸、聚乙烯亚胺 (PEI),以及磷酸钠缓冲液的所有组分均可从 Sigma-Aldrich 获得。浓度、纯度、CAS号和MSDS链接在支持信息中提供。
步骤
方法的完整描述在支持信息中给出。简而言之,在第一周,通过用 1 mM HCl 水解 1 M TMOMS 来进行沉淀反应。这是为每次课程新鲜制备的。技术人员制备了 290 mM 磷酸钠的缓冲溶液,pH 7.4,以及 1 mM PEI 溶液。所有溶液均使用超纯水()。各组分按以下顺序加入八个微量离心管中:水、缓冲液、PEI,然后是水解的 TMOMS。各组分的最终浓度为 29 mM 磷酸盐缓冲液、0.1 mM PEI 和 0.1 M TMOMS。
通过涡旋混合将各种组分混合,约 15 分钟后形成浑浊的颗粒沉淀物。在 和 120 分钟的时间点,将两个管子放入离心机中以 离心 4 分钟。通过在水中超声处理进行重悬来洗涤颗粒,然后再次离心使颗粒沉降。移除上清液并重复洗涤过程。离心和洗涤会停止反应。第二次洗涤后,将颗粒重悬于刚好能覆盖沉降颗粒的水中。该方法为四个时间点中的每一个都生产了两管微量离心管的颗粒,从而为表征提供了足够的样品。
对于颗粒的制造,需要使用微量离心机(和适当的管子)。如果没有微量离心机,可以使用较大的台式离心机,并适当按比例增加试剂的体积。
颗粒制备完成后,应储存样品然后准备进行表征。颗粒的表征需要进一步的方法,如扫描电子显微镜 (SEM) 和动态光散射 (DLS)。这取决于仪器的可用性,但在我们的案例中,电子显微镜部门的经理在实验的第二周之前为学生准备了 SEM 样品。然后他给学生们进行了关于样品制备和显微镜操作的辅导,并在第二节课期间对学生的样品进行成像,通常学生们都在场。在我们的实验中,颗粒从水性悬浮液中安装到铝桩上,并在用金进行溅射镀膜之前使其干燥。SEM 图像可以使用 SEM 软件或免费软件如 UTHSCSA Image Tool 或 Image J 进行粒径分析。
此外,颗粒通过 DLS 进行了表征。理想情况下,学生们会得到关于尺寸测量仪器的简短辅导,然后由经过全面培训的操作员在他们在场的情况下或由学生自己测量他们的粒径。这将取决于仪器的可用性和实验课的时间限制。在我们的案例中,使用了一台可以测量高达 3000 nm 粒径的仪器(Zetasizer Nano, Malvern Instruments)。颗粒也可以用光学显微镜观察,但这只能提供定性结果,并取决于颗粒的大小和显微镜的放大倍率(图 S1,支持信息)。
- 危害
TMOMS 高度易燃,不应在明火附近操作。PEI 被归类为有害,吞食有害,对水生生物有毒,对环境有危险,没有适当的安全措施不应使用。纯净的 PEI 应仅由技术人员操作。学生将得到稀释的 PEI 溶液。佩戴手套和护目镜,并在通风柜中执行整个程序。实验中产生的二氧化硅和硅烷废物应与聚合物废物分开统一处理,并正确标记以便妥善处置(更多细节见支持信息)。
- 结果与讨论
这个实验室实验以两人小组的形式进行,每次有一到两个小组同时进行实验,与实验课程中运行的其他实验轮流进行。实验分两次 3 小时的实践课程进行,第一节课进行颗粒制造,第二节课进行表征和结果解释。DLS 和 SEM 粒径测定结果的平均值显示在表1中。这些结果是
表1. 用 DLS 和 SEM 图像分析在不同反应时间获得的二氧化硅颗粒直径
| 反应时间/分钟 | DLS 直径 (强度平均)/ nm | DLS 直径 (数量平均)/ nm | SEM 直径/ nm |
|---|---|---|---|
| 30 | |||
| 60 | |||
| 90 | |||
| 120 |
来自在 2010 和 2011 年进行该实验的八对学生。DLS 结果以强度和数量平均颗粒流体动力学直径给出。 在不同反应时间产生的颗粒在 放大倍率下的示例图像如图1所示。图像清楚地显示,颗粒尺寸在第一个和最后一个时间点之间增加了。
图2绘制了通过 DLS 强度和数量平均以及平均 SEM 值测量的颗粒直径随孵育时间变化的函数。数据显示,随着反应时间的增加,颗粒直径明显增加。DLS 数量平均值和 SEM 值如预期般非常吻合,而 DLS 强度平均值则更高,因为在多分散样品中它对较大的颗粒有加权。 关于 DLS 的更多细节在支持信息中给出。
 图1. 一个小组在反应开始后 (A) 30 分钟和 (B) 120 分钟时生产的颗粒的 SEM 图像。比例尺为 500 nm。
图1. 一个小组在反应开始后 (A) 30 分钟和 (B) 120 分钟时生产的颗粒的 SEM 图像。比例尺为 500 nm。
 图2. 平均颗粒直径随孵育时间的变化,显示了八组学生的平均值和线性趋势。数据是使用 Malvern Zetasizer Nano 获得的,其中直径结果以强度平均(菱形)、数量平均(方形)和使用 Image Tool 软件的 SEM 图像分析(三角形)表示。误差棒显示标准差。
图2. 平均颗粒直径随孵育时间的变化,显示了八组学生的平均值和线性趋势。数据是使用 Malvern Zetasizer Nano 获得的,其中直径结果以强度平均(菱形)、数量平均(方形)和使用 Image Tool 软件的 SEM 图像分析(三角形)表示。误差棒显示标准差。
- 结论
本实验为高年级本科生提供了一个观察和讨论球形颗粒成核、生长和尺寸测定的机会,并对球形颗粒悬浮液的胶体稳定性进行评论。
- 相关内容
(S) 支持信息
提供给学生的实验步骤、给指导教师的说明、给技术人员关于分析物制备和安全考虑的说明。该材料可通过互联网在 http://pubs.acs.org 获取。
- 作者信息
通讯作者
*电子邮件: Frances.Neville@newcastle.edu.au.
注释
作者声明没有竞争性经济利益。
- 致谢
作者感谢电子显微镜/X射线部门的 David Phelan 进行扫描电子显微镜检查。感谢纽卡斯尔大学本科 CHEM3580 实验室的学生们的参与和汇总的结果,以及 Vicki Thompson 在实验室提供的技术援助。
参考文献
(1) Stöber, W.; Fink, A.; Bohn, E. J. Colloid Interface Sci. 1968, 26, 62-69. (2) Bogush, G. H.; Tracy, M. A.; Zukoski, C. F., IV J. Non-Cryst. Solids 1988, 104, 95-106. (3) Buckley, A. M.; Greenblatt, M. J. Chem. Educ. 1994, 71, 599-602. (4) Neville, F.; Pchelintsev, N. A.; Broderick, M. J.; Gibson, T.; Millner, P. A. Nanotechnology 2009, 20, 055612. (5) Schröder, H. C.; Wang, X.; Tremel, W.; Ushijima, H.; Müller, W. E. G. Nat. Prod. Rep. 2008, 25, 455-474. (6) Losic., D.; Mitchell, J. G.; Voelcker, N. H. Adv. Mater. 2009, 21, 2947-2958. (7) UTHSCSA ImageTool. http://ddsdx.uthscsa.edu/dig/itdesc. html (2012年4月访问). (8) ImageJ. http://rsbweb.nih.gov/ij/ (2012年4月访问). (9) Dynamic Light Scattering. http://www.malvern.com/common/ downloads/campaign/MRK656-01.pdf (2012年4月访问).
[^0]: 发表日期: 2012年4月27日